Интравитреальная инъекция является одним из наиболее популярных, но в тоже время и наиболее эффективных методов лечения офтальмологических заболеваний. Впервые интравитреальное введение было выполнено Ohm J. в 1911 году с целью тампонады сетчатки стерильным воздухом. В 40-х годах XX века интерес к этой процедуре начал расти, были выполнены экспериментальные исследования интравитреального применения антибактериальных препаратов при лечении воспалительных заболеваний глаз. В 1970-х годах проведены работы по лечению пролиферативной витреоретинопатии методом интравитреальной инъекции антионеопластических препаратов. В 80-90-х годах было исследовано интравитреальное введение антивирусных средств.
В последнее же десятилетие широкое распространение получило интравитреальное введение ингибитора ангиогенеза, представляющий собой высокоэффективный метод лечения заболеваний сетчатки глаза, сопровождающихся ростом новообразованных патологических сосудов.
Так по мере развития научных представлений о патогенезе глазных болезней и совершенствования технологий фармакологической промышленности интравитреальное введение препарата стало вариантом выбора при лечении различной патологии органа зрения, а перечень используемых препаратов существенно расширился.
Что такое интравитреальное введение препарата
Изнутри полость глазного яблока заполнена прозрачной гелеобразной субстанцией, называемой стекловидным телом. Интравитреальная инъекция подразумевает введение лекарственного препарата в полость глазного яблока с помощью иглы. Большинство лекарственных препаратов, при использовании их в форме глазных капель или мазей, не достигают сетчатки. В то время как основная часть офтальмологической патологии требует доставки лекарств непосредственно к ретинальной области.
Достичь необходимого эффекта можно только посредством интравитреального введения препарата, поскольку наличие особого клеточного барьера не позволяет медикаментам, введенным в вену или мышцу, попасть к сетчатке. Этот лечебный метод играет важнейшую роль в терапии многих глазных заболеваний. Каждое заболевание требует введения определенных препаратов, о которых речь пойдет ниже.
Перечень лекарственных препаратов и показания к такому их введению продолжают постоянно расширяться, а научные исследования в данном направлении проводятся во всем мире и в настоящее время.
Показания к интравитреальной инъекции
Перечень показаний к интравитреальному введению лекарственных препаратов определяются индивидуально в зависимости от имеющегося у каждого конкретного пациента глазного заболевания. С помощью этого метода можно успешно лечить тяжелые и потенциально приводящие к полной или частичной потере зрения заболевания глазного дна, такие как:
- Сенильная макулярная дегенерация, влажная форма.
- Клинически значимый макулярный отек, являющийся следствием пролиферативной диабетической ретинопатии.
- Эндофтальмиты.
- Увеиты.
- Окклюзия центральной вены сетчатки или ее ветвей.
- Хориоидальная неоваскулярная мембрана, возникшая вторично вследствие множественной ретинальной патологии.
- Кистозный отек макулы.
Преимущества и недостатки метода
Как и любой лечебный метод, интравитреальное введение лекарственных препаратов имеет свои плюсы и минусы. Неоспоримым преимуществом является целевая доставка, большая вероятность полноценного терапевтического эффекта и относительно невысокие риски системных нежелательных реакций. Эти преимущества и получаемый терапевтический эффект являются очень «заманчивыми» для специалистов-офтальмологов. Однако риски возникновения возможных осложнений всегда должны быть на второй чаше весов.
Наиболее серьезным осложнением процедуры является бактериальная контаминация и возникающий вследствие инъекции эндофтальмит. Последние научные исследования в данной области определяют риск возникновения эндофтальмита как 0,051% при выполнении каждой конкретной инъекции. Однако, при соблюдении медперсоналом всех асептических мероприятий, риски бактериальной контаминации сводятся к минимуму.
Другие документально подтвержденные осложнения включают:
- Отслойку сетчатки.
- Стойкую внутриглазную гипертензию.
- Субконъюнктивальные или внутриглазные кровоизлияния.
- Повреждения хрусталика.
- Развитие или прогрессирование уже имеющейся катаракты.
- Гипотонию, аллергические или анафилактические реакции.
При планировании интравитреального введения лекарственных препаратов пациенту необходимо подробно объяснить все преимущества метода, а также риски и возможные осложнения. К процедуре приступают только после получения добровольного информированного согласия пациента.
Техника выполнения процедуры
Интравитреальные инъекции проводятся амбулаторно, то есть после процедуры пациент в госпитализации не нуждается, и может после кратковременного наблюдения и получения врачебных назначений идти домой. Ввиду малого диаметра используемой иглы ее введение в полость глаза сопровождается минимальным дискомфортом, вследствие чего применение анестезирующих глазных капель обычно вполне достаточно для операционного комфорта пациента. В редких случаях используется субконъюнктивальная инъекция лидокаина с целью дополнительного обезболивания. Для профилактики бактериальной контаминации производится обработка конъюнктивального мешка йодсодержащим антисептиком. Используется только стерильный хирургический инструментарий, а также врач выполняет тщательную обработку рук и использует стерильные перчатки. Интравитреальное введение ингибитора ангиогенеза, стероидных препаратов или антибиотиков проводится по стандартной методике.
В качестве ретрактора используется векорасширитель. Он необходим для предотвращения непроизвольных морганий глазом, что может помешать работе врача. Предоперационное введение антибиотика остается на усмотрение лечащего врача и чаще применяется при наличии сопутствующих инфекционных состояний, в частности, блефарита. Однако в ходе научных исследований не получено достоверных данных о снижении рисков эндофтальмита при предоперационном использовании антибактериальных препаратов. Для интравитреального введения препаратов используются иглы толщиной 27-30G. Место инъекции должно быть в 3,5-4 мм от лимба для людей с собственным хрусталиком. Для пациентов после замены хрусталика расстояние должно быть 3-3,5 мм. Эти расстояния основаны на анатомических особенностях глазного яблока: игла должна пройти в особом месте, называемом по-латыни pars plana, минуя хрусталик и сетчатку. В процессе инъекции пациента просят смотреть в противоположную сторону от квадранта, в котором производится вмешательство. После попадания иглы в полость стекловидного тела производится небыстрое введение препарата.
После выполнения манипуляции хирург должен убедиться в наличии адекватной циркуляции по ретинальной артерии. Иногда для того чтобы удостовериться в отсутствии осложнений необходима послеоперационная офтальмоскопия. Послеоперационная антибиотикопрофилактика также остается на усмотрение хирурга-офтальмолога. Первичный мониторинг внутриглазного давления осуществляется сразу после инъекции, затем по прошествии 5-10-минутного промежутка. Если через 20 минут снижение не наблюдается, рекомендовано использование гипотензивных препаратов. После соблюдения всех мер предосторожности пациент может покинуть офтальмологическую клинику.
Обсуждение
Резюме основного результата исследования
Полученные результаты свидетельствуют о влиянии ИВВ ранибизумаба на содержание ключевого фермента РАС – АПФ как в системном кровотоке, так и локально в CЖ.
До лечения у пациентов с ДМО выявлено почти двукратное повышение содержания АПФ в СЖ при одновременном двукратном снижении концентрации этого фермента в С.К. Под воздействием антиангиогенной терапии отмечалось снижение АПФ в С.Ж. Причем эта закономерность отмечалась как для глаза с ДМО и ИВВ, так и для парного глаза, куда инъекция не проводилась. Уровень АПФ в СК у пациентов с ДМО после инъекции постепенно повышался, однако не достигал показателей контрольной группы.
У пациентов с ВМД до лечения концентрация АПФ в СК и СЖ практически не отличалась от контрольных значений. После ИВВ ранибизумаба происходило снижение исходно нормальных уровней АПФ в С.Ж. Причем это отмечалось как на глазу с вВМД, в который проводилась инъекция, так и на парном глазу. Концентрация АПФ в СК на фоне ИВВ при ВМД существенно не менялась.
Обсуждение основного результата исследования
Изменение концентрации АПФ в СЖ на парном глазу, в который не проводилась ИВВ, является интересным наблюдением. Можно было бы думать о системном влиянии препарата, однако отсутствие изменения концентрации АПФ в СК противоречит этому предположению и наталкивает на мысль об окуло-окулярных взаимодействиях, обусловленных сложным комплексом нейрогуморальных механизмов [14].
РАС играет важную роль в прогрессировании ДР [15]. Повышение концентрации AII, АПФ, VEGF в тканях глаза увеличивает риск неоваскуляризации и увеличения проницаемости сосудов [16]. Доказано повышение концентрации AII, VEGF и проренина в стекловидном теле у пациентов при тяжелом течении ПДР [17].
Ранее при исследовании активности АПФ у больных ДР нами было выявлено ее повышение в СК по мере прогрессирования заболевания при одновременном снижении активности АПФ в СЖ [18]. В настоящей работе, напротив, было обнаружено повышение концентрации АПФ в СЖ у пациентов с ДМО. Возможно, эти различия связаны с действием эндогенных ингибиторов фермента [19]. Полученные данные свидетельствуют о необходимости сопоставления изменений системного и локального содержания и активности АПФ при ДР.
Известно, что АПФ участвует не только в образовании AII, но и распаде брадикинина, который при снижении содержания АПФ может накапливаться в тканях глаза [20]. Брадикинин относится к калликреин-кининовой системе и способствует усилению проницаемости сосудов, вызывает вазодилятацию и может усиливать отек тканей. Обнаруженное нами снижение концентрации АПФ в СК у больных с ДМО может быть причиной меньшего поступления этого фермента с кровотоком в сетчатку и приводить к накоплению брадикинина, создавая условия для появления макулярного отека. Уменьшение количества брадикинина могло бы снижать риск возникновения ДМО, что открывает новые перспективы для терапии данного состояния. Возможно, снижение содержания АПФ в крови является характерной особенностью больных с ДМО и может быть использовано как дополнительный прогностический критерий отека у пациентов с ДР.
Снижение концентрации АПФ в СЖ у пациентов с ДМО и ВМД после ИВВ ранибизумаба свидетельствует о взаимосвязи локальной РАС и ангиогенной системы и обосновывает поиск новых возможностей лечения ДМО с помощью коррекции РАС.
Интравитреальное введение Луцентиса
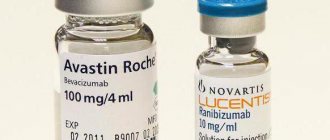
Луцентис представляет собой ингибитор ангиогенеза, действующим веществом которого является ранибизумаб. Механизм действия Луцентиса при его интравитреальном введении обусловлен блокадой рецепторов, необходимых для адгезии и связывания эндотелиального сосудистого фактора роста. Ранибизумаб, взаимодействуя с рецепторами на поверхности эндотелиальных клеток, предотвращает клеточную пролиферацию, просачивание жидкости и образование аномальных кровеносных сосудов.
Луцентис получил широкое применение в антиангиогенной терапии неоваскулярной формы сенильной дегенерации сетчатки, макулярном отеке, ассоциированном с окклюзией ретинальной вены, диабетической ретинопатии и возникающем на ее фоне отеке макулы. Наиболее часто используемая дозировка – 0,5 мг Луцентиса 1 раз в месяц. Длительность курса лечения определяет лечащий врач, обычно она составляет около 6 месяцев.
Интравитреальное введение Авастина
Данный препарат также относится к группе антивазопролиферативных агентов, действующим веществом которого является бевацизумаб. Ранее такого рода моноклональные антитела использовались для лечения онкологической патологии, в частности, злокачественных опухолей желудка и кишечника. Позже была доказана эффективность бевацизумаба при его интравитреальном введении в качестве ингибитора ангиогенеза в терапии диабетической ретинопатии и влажной формы дистрофии сетчатки.
Механизм действия аналогичен с таковым ранибизумаба (Луцентиса). Авастин позволяет приостановить процессы формирования новых кровеносных сосудов и просачивание жидкости через сосудистую стенку, что помогает пациентам, как можно дольше сохранить зрительные функции.
Интравитриальные инъекции
По сложности и техническим тонкостям интравитреальное введение раствора Эйлеа очень близко к микрохирургической операции. В связи с этим, выполняется оно опытным хирургом в условиях стерильной операционной.
При подготовке к инъекции проводят обработку дезинфицирующим раствором близлежащих кожных покровов. Делают эпибульбарную (капельную) анестезию, которая полностью блокирует чувствительность поверхности склеры.
https://www.youtube.com/watch?v=https:accounts.google.comServiceLogin
Инъекция выполняется специальным шприцом, которым осуществляют частичный сквозной прокол определенной области цилиарного тела на глубину до 3 мм. Препарат вводится медленным нажатием поршня, после чего игла извлекается. Фиксации прокола или наложения швов не требуется.
В окончании процедуры, обязателен контроль внутриглазного давления. При его значительном повышении может быть осуществлен парацентез – прокол роговицы в лимбальной области.
На завершающем этапе, в глаз закапывают специальные капли с антимикробным и противовоспалительным действием, которые необходимо продолжать капать по определенной схеме следующие три дня дома.
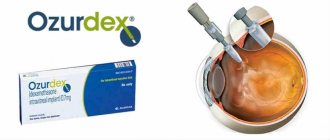
Интравитреальное введение «Озурдекса»
«Озурдекс» представляет собой препарат для интравитреальной инъекции, содержащий 0,7 мг стероидного гормона дексаметазона. Целью интравитреального введения «Озурдекса» являет подавление воспалительной реакции посредством подавления множества воспалительных цитокинов. Клинически это проявляется в уменьшении отека, отложения фибрина, минимизация капиллярного пропотевания и миграции воспалительных клеток.
Показаниями к интравитреальному использованию «Озурдекса» является окклюзия ретинальной вены (основного ствола или ветвей), увеит заднего сегмента глаза и диабетический макулярный отек. Вопрос о повторной инъекции «Озурдекса» решается после оценки динамики состояние глазного дна. Вводимый препарат обладает пролонгированным эффектом.
Какие побочные эффекты могут быть у анти-VEGF препаратов и интравитреальных инъекций?
После интравитреальной инъекции возможна легкая боль, покраснение глаза (кровоизлияние в месте укола), жжение и слезотечение (особенно после проходящего эффекта анестезии). Также возможны повышенная чувствительность к свету, ощущение инородного тела и плавающие помутнения. Эти побочные эффекты носят временный характер, не требуют какого-либо лечения или вмешательства и проходят самостоятельно в течение нескольких часов или дней. Серьёзные осложнения при интравитреальной инъекции крайне редки.
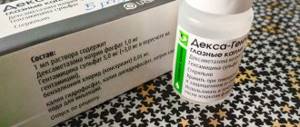
Интравитреальное введение Гемазы
Химическое вещество, содержащее в данном препарате – проурокиназа. Оно относится к фибринолитическим средствам, то есть обладает способностью трансформировать плазминоген в плазмин, тем самым подвергая лизису уже сформировавшиеся тромбы. Для интравитреального введения используется 500 МЕ активного вещества.
Показания к применению: частичный гемофтальм или субтотальный и тотальный гемофтальм без признаков отслойки сетчатки по результатам ультразвукового исследования, окклюзия центральной вены или артерии сетчатки или их ветвей, суб-, интра- и преретинальные кровоизлияния. При локальном использовании риски системной кровоточивости минимальны или вовсе отсутствуют. Препарат противопоказан при связанных с гипокоагуляцией заболеваниях крови, а также при выраженной печеночной недостаточности.
Интравитреальная инъекция Кеналога
Действующим веществом препарата Кеналог является триамцинолон. Это синтетический глюкокортикостероидный гормон. Его эффект основан на подавлении ангиогенеза, воспалительных реакций посредством блокировки миграции и пролиферации клеток воспаления. Стероиды также блокируют выработку эндотелиального фактора роста, стабилизируют клеточные мембраны и снижают сосудистую проницаемость, что важно для лечения обширного спектра офтальмологических заболеваний.
Интравитреальное введение Кеналога показано при диабетическом и кистозном макулярном отеке, окклюзии ретинальной вены, а также при влажной форме возрастной дистрофии сетчатки.
Интравитреальная инъекция антибиотика
Введение антибактериальных препаратов интравитреально представляет собой наиболее эффективный способ лечения эндофтальмита. Интравитреальное введение антибиотиков является единственным способом достижения их терапевтической концентрации в полости стекловидного тела, так как гематоретинальный барьер не позволяет препаратам из системного кровотока проникать в полость глазного яблока. При своевременном применении возможно получение хорошего лечебного эффекта и сохранение высоких зрительных функций.
Для лечения бактериального эндофтальмита, вызванного грамположительной флорой, используются такие препараты, как Ванкомицин и Цефазолин. При грамотрицательных возбудителях рекомендовано применение Цефтазидима, Амикацина и Гентамицина. Иногда антибактериальные препараты комбинируют с интравитреальным введением кортикостероидов.
Интравитреальное введение Эйлеа
Эйлеа также является ингибитором ангиогенеза, действующим веществом которого является афлиберцепт. Каждый шприц с раствором Эйлеа содержит 40 мг активного вещества. Афлиберцепт является моноклональным антителом, обладающим выраженными антипролиферативными свойствами.
Механизм действия заключается в связывании и предотвращении активации эндотелиального ростового фактора и плацентарного фактора роста. Таким образом, эффект препарата также заключается в блокаде неоваскуляризации и предотвращении макулярного отека.
Показания к использованию афлиберцепта: влажная форма макулярной дегенерации, ассоциированный с тромбозом ретинальной вены отек макулы, диабетическая ретинопатия.