Что может произойти до рождения малыша?
В период внутриутробного развития в зрительном аппарате ребенка могут произойти процессы, которые станут причиной врожденной, или антенатальной, патологии глаза. Под этим понятием скрываются различные нарушения в строении и функции глаз, а также их придаточного (вспомогательного) аппарата, обусловленные неправильным их формированием.
Как правило, к появлению таких дефектов приводят изменения в генах малыша. Они могут быть унаследованы им от родителей, но чаще возникают в результате воздействия на организм будущей мамы тератогенных (то есть способных вызывать мутации) факторов, к числу которых относятся:
- некоторые инфекции (например, краснуха, токсоплазмоз и цитомегаловирус);
- алкоголь;
- курение;
- определенные лекарственные средства.
В зависимости от того, на какой стадии внутриутробного развития произошла мутация, формируется аномалия строения одной или нескольких составляющих зрительного аппарата.
Наиболее часто развивается такая патология, как птоз (опущение) верхнего века. Она приводит к снижению остроты зрения и незначительному сужению его полей, так как не позволяет полноценно функционировать сетчатой оболочке.
Нарушением зрения сопровождается и врожденное изменение размеров глазного яблока (микрофтальм), которое часто возникает на фоне синдромной генетической патологии, но может появиться и в изолированном виде, если контакт с мутагеном произошел на второй – шестой неделе внутриутробного развития малыша.
Примерно на третьей – четвертой неделе развития формируется главная глазная линза – хрусталик, врожденные патологии которой всегда сопровождаются снижением остроты зрения и могут приводить к косоглазию. Распространены такие дефекты, как:
- недоразвитие или полное отсутствие хрусталика (афакия);
- изменение его формы – лентиконус;
- уменьшение в размерах – микрофакия.
Они могут сочетаться со смещением хрусталика, то есть его эктопией, способной провоцировать повышение внутриглазного давления и развитие вторичной глаукомы. Глаукома, в свою очередь, может приводить к гибели клеток сетчатки и зрительного нерва. Зрительный нерв – это важнейшая часть аппарата глаза, ответственная за передачу импульсов в головной мозг. Он формируется с третьей по десятую неделю развития плода. Мутации могут привести к недоразвитию и полному отсутствию нервных волокон, а также образованию в их области колобом. Выраженные изменения зрительного нерва сопровождаются полной слепотой.
К стойкой слепоте могут приводить и выявляющиеся примерно у каждого двадцатого ребенка, страдающего глазной патологией, аномалии развития сосудистой оболочки. Часто они проявляются отсутствием одного или нескольких ее фрагментов, то есть наличием колобом.
Врожденные колобомы глаза появляются на одной из ранних стадий внутриутробного развития плода вследствие нарушения процесса закрытия так называемой эмбриональной щели. Нередко они затрагивают несколько структур зрительного аппарата (сетчатку, радужку и собственно сосудистую оболочку), и сильно нарушают их функции. От 3 до 11% детской слепоты в мире приходится на долю этой патологии. Нередки случаи, когда колобомы сочетаются с нарушением деятельности нервной и костно-мышечной системы ребенка.
Перечисленные аномалии развития могут сопровождаться различными дефектами строения сетчатки – тонкого слоя клеток, способных воспринимать и передавать в головной мозг световые импульсы. Эти дефекты часто вызывают потерю зрения в детском возрасте.
Отдел работает над решением актуальных проблем офтальмологии, от успешной разработки которых зависит предупреждение слепоты и слабовидения у детей. Научные исследования отдела посвящены изучению этиологии, патогенеза и разработке новых эффективных методов диагностики и лечения тяжелых врожденных, наследственных и приобретенных заболеваний глаз у детей: ретинопатии недоношенных; врожденных, травматических и осложненных катаракт; врожденной и вторичной глаукомы; врожденных аномалий и пороков развития глаз; врожденных и приобретенных увеитов, патологии сетчатки и зрительного нерва, помутнений роговицы; повреждений глаз у детей. Оснащение отдела новейшим диагностическим оборудованием, компьютерными комплексами для проведения спектральной оптической когерентной томографии (ОКТ), в том числе с ОКТ- ангиографией, Гейдельбергской ретинальной томографии, ультразвуковых исследований для сканирования и ультразвуковой биомикроскопии глаза, допплерографии, электрофизиологических и психофизических исследований, компьютерной периметрии, флюоресцентной ангиографии с возможностью получения мультимодальных изображений структур глаза, существенно повысило уровень диагностики и эффективность лечения заболеваний глаз у детей. Так, применяющийся в отделе с 2021 года новый метод — ОКТ-ангиография, позволил без внутривенного введения красителя осуществлять визуализацию поверхностного и глубокого ретинальных капиллярных сплетений, слоя хориокапилляров, что важно для диагностики и мониторирования различной патологии глазного дня у детей, сопровождающейся развитием интраретинальных ишемических процессов, формированием новообразованных сосудов и др. В России отдел является пионером в лечении детей с врожденными катарактами, глаукомой, ретинопатией недоношенных. Оптимизированы и внедрены в практику современные микроинвазивные хирургические методы экстракции врожденных катаракт с имплантацией ИОЛ детям грудного возраста, при синдромной патологии, подвывихах хрусталика и запатентованные методы хирургического лечения при синдроме первичного персистирующего гиперпластического стекловидного тела, микрофтальме и др., что позволило у всех детей получить хорошие анатомо-оптические результаты с повышением остроты зрения у 88% детей. Активное внедрение в практику детской офтальмологии современных высокоинформативных и объективных методов визуализации структур переднего и заднего отрезков глаза, существенно повысило уровень и эффективность диагностики тяжелых форм врожденной глаукомы, сочетанных с аномалиями глаза и синдромной патологией (аниридия, синдром Аксенфельда-Ригера и др.), позволило диагносцировать заболевание на ранних стадиях, своевременно проводить адекватное лечение, сохранить и повысить зрительные функции у 93,5% детей. Разработанный комплекс инструментальных и функциональных методов ранней диагностики и оценки прогрессирования врожденной глаукомы, внедрение новых видов операций, современных технологий (ультразвук, лазеры, дренажи) и различных антипролиферативных средств повысил частоту компенсации внутриглазного давления после операции до 98,5% и через 5 и более лет – до 86,4% детей. Одним из приоритетных направлений является изучение различных аспектов проблемы ретинопатии недоношенных: исследования патогенеза, разработка новых высокотехнологичных методов диагностики и лечения различных форм и стадий заболевания у детей с первых недель жизни, что позволяет остановить прогрессирование процесса и сохранить зрение в 94% случаев. Выполняются ранние ленссберегающие операции детям с 4а и 4в стадиями активной ретинопатии недоношенных, достигнуто прилегание сетчатки в 85-100% и 87-94% случаев соответственно. Разработана система диспансерного наблюдения пациентов, перенесших разные формы и стадии РН, позволяющая своевременно выявлять и проводить адекватную коррекцию различных нарушений зрения, предупреждать и лечить поздние осложнения заболевания (дистрофия и отслойка сетчатки) и сопутствующей патологии глаза (миопия, глаукома и т.д). Отдел является единственным медицинским учреждением страны, в котором проводятся сложные оптико-реконструктивные операции сквозной кератопластики при тяжелых врожденных и приобретенных помутнениях роговицы детям с 1 месяца жизни. Отдел является лидером по лечению эндогенных увеитов у детей. Разработанный комплекс современной иммунологической диагностики, этиопатогенетической терапии с применением новейших иммуносупрессивных препаратов, в том числе генно-инженерных, снижает частоту рецидивов и тяжелых осложнений воспалительного процесса. Высокотехнологичное микрохирургическое лечение последствий увеитов: экстракции катаракт с имплантацией ИОЛ, микроинвазивные вмешательства при глаукоме и витреоретинальной патологии значительно повышает эффективность лечения. Современные микроинвазивные вмешательства проводятся при тяжелой и ранее инкурабельной врожденно-наследственной и приобретенной витреоретинальной патологии детского возраста: семейной экссудативной витреоретинопатии, осложненной ямке ДЗН, витреоретинальной тракции, макулярном разрыве, «поздней» отслойке сетчатки при ретинопатии недоношенных. Разработана дифференцированная тактика хирургического лечения отслойки сетчатки различного генеза в детском возрасте. Применяются новые технологии эндовитреальной хирургии с использованием современных микроинвазивных инструментов (25 и 27 G). Выполняются различные виды экстрасклерального пломбирования, комбинированные вмешательства с витрэктомией и интравитреальной тампонадой расширяющими газами, силиконовым маслом, что позволяет достичь прилегания сетчатки, сохранить и улучшить остроту зрения у 95% детей. В отделе впервые проведены медико-генетические и популяционные исследования наследственной патологии органа зрения у детей, позволяющие своевременно выявлять, лечить и прогнозировать заболевание, в том числе генетически-детерминированные синдромы. В отделе развиваются и совершенствуются лазерные технологии. Впервые в детской офтальмологии разработана и внедрена высокоэффективная система ИАГ- лазерных реконструктивных операций детям любого возраста (младшим — под наркозом). Лазерные операции без вскрытия глазного яблока успешно заменяют ряд инструментальных хирургических вмешательств при вторичных катарактах, кистах радужки, зрачковом блоке, заращении зрачка и послеоперационных фистул, витреальных швартах. Выполнено более 5 тысяч лазерных операций, эффективность через 2-17 лет от 87,7 до 97,3% при разной патологии. Внедрены в клиническую практику отдела методики диод-лазерной коагуляции сетчатки при витреоретинальной патологии: активных стадиях ретинопатии недоношенных, семейной экссудативной ретинопатии, болезни Коатса, периферических витреохориоретинальных дистрофиях, ретиношизисе, ангиоматозах и ангиитах сетчатки. Выполняются транссклеральные Диод-лазерные циклокоагуляции при терминальных стадиях глауком различного генеза у детей. Проводится лазерное плеоптическое лечение при обскурационной амблиопии. Создана компьютерная база данных офтальмологических исследований, архив медицинской документации отдела.
Аномалии глаз, связанные с заболеваниями других органов
Перечислим самые известные и тяжелые патологии, которые влияют на формирование органов зрения у эмбриона и у ребенка после рождения по мере роста. Возникают они вследствие генетической мутации. Типичными болезнями, которые имеют в своей симптоматике офтальмологические нарушения, можно назвать:
- Альбинизм. При этом наследственном заболевании вырабатывается мало пигмента меланина, который отвечает за цвет кожи, волос, ногтей, радужной оболочки. У альбиносов радужка практически прозрачная. Из-за этого внутренние структуры глаза становятся менее защищенными от света. У людей с альбинизмом сквозь белочную оболочку просвечивают сосуды. Глаза у них имеют красноватый оттенок. Зачастую у альбиносов диагностируют несколько патологий, связанных с органами зрения: фотофобию, нистагм, гиперметропию.
- Синдром Франчески — болезнь, при которой наблюдается аномальное строение костной ткани лицевого скелета. Патология начинает развиваться еще на 6-7 неделе формирования плода. Симптомы синдрома отчетливо видны уже у новорожденного: уголки глаз опускаются, одно или оба века отсутствует. У некоторых пациентов диагностируют микрофтальм, который впоследствии приводит к дальнозоркости.
- Синдром Дауна. У большинства пациентов с этим заболеванием возникают дефекты рефракции: астигматизм, миопия или гиперметропия. Также у них может быть очень слабый аккомодационный аппарат. У многих детей с синдромом Дауна наблюдается неправильное строение носослезного канала.
- Синдром Марфана — болезнь, проявляющаяся в повышенной растяжимости тканей. 50% больных с этим диагнозом страдает от близорукости. Причиной этого становится аномальное строение хрусталика, роговицы и глазного яблока, вызванного растяжением. Чаще чем у других людей, у пациентов с синдромом Марфана развивается катаракта.
Эти болезни, как правило, не поддаются лечению. Сопутствующие им глазные патологии корректируют очками/линзами и лечатся путем хирургического вмешательства.
Генная терапия одного глаза улучшила зрение и в другом
giphy.com
Клинические испытания генной терапии против наследственной оптической нейропатии Лебера завершились неожиданным успехом: хотя участникам вводили препарат только в один глаз, зрение достоверно улучшилось в обоих. Позже организаторы испытаний повторили этот эксперимент на макаках и подтвердили, что вирусный вектор действительно мигрирует из одного глаза в другой. Но как ему это удается, до сих пор неизвестно. Исследование опубликовано в журнале Science Translational Medicine
.
Оптическая нейропатия Лебера — наследственная болезнь с неблагоприятным прогнозом. Ее вызывает ряд точечных мутаций в митохондриальной ДНК, которые оказываются особенно опасны для ганглионарных клеток сетчатки. Эти клетки постепенно погибают, а вместе с ними деградирует и зрительный нерв. Поэтому человек может потерять зрение практически полностью всего за год после появления первых симптомов.
Сегодня для нейропатии Лебера, как и для множества наследственных болезней, нет надежного лечения — только препарат, который поддерживает функцию митохондрий на ранних стадиях болезни. Изменить ситуацию в корне можно было бы с помощью генной терапии — то есть ввести в ганглионарные клетки здоровую копию гена. По такому принципу уже работают препараты против еще одной глазной болезни — амавроза Лебера — которая поражает фоторецепторы сетчатки. Правда, в этом случае решить проблему проще, поскольку мутатный ген находится в ядерной ДНК.
Международная группа ученых под руководством Жозе-Алена Саэля (José-Alain Sahel) разработала способ восстановить митохондриальный дефект с помощью генной терапии. Исследователи сконструировали аденовирусный вектор с необходимым геном, причем в белок, который он кодирует, встроили сигнал митохондриальной локализации — то есть метку, которая позволит ему попасть внутрь митохондрии из цитоплазмы.
Сейчас исследователи отчитались о третьей фазе клинических испытаний своей терапии. Для нее они отобрали 37 пациентов, каждому из которых в один глаз вводили настоящий препарат, а в другой — плацебо, причем глаза были выбраны случайным образом, так что ни сами пациенты, ни врачи не знали, что в какой глаз попало.
По замыслу организаторов испытаний, один из глаз должен был служить контролем для второго, а разница между их состоянием — показателем эффективности терапии. Однако, когда пришло время подводить итоги, они обнаружили, что глаза, в которые вводили плацебо, тоже начали в среднем видеть лучше, и различия между двумя группами глаз оказались несущественными (p = 0,894). Всего зрение улучшилось существенно в 62 процентах глаз, получивших лекарство, и 43 процентах глаз, которым досталось плацебо. При этом у 68 процентов пациентов за два года стал лучше видеть хотя бы один глаз, из них у двух человек это был не тот глаз, в который ввели препарат.
Улучшение зрения в группе контрольных и экспериментальных глаз за два года наблюдений
Yu-Wai-Man et al. / Sci Transl Med, 2020
Поделиться
Глазные болезни не просто так становятся мишенью для отработки новых методов лечения — глаз считается иммунопривилегированным органом, отделенным от системного кровотока надежными барьерами. Именно это позволяет ученым вводить в него вирусные векторы или подсаживать стволовые клетки, не боясь навредить остальному организму или вырастить опухоль с метастазами. Тем удивительнее оказался результат этого испытания: если зрение улучшилось и во втором глазу, значит, должны существовать какие-то пути сообщения между двумя глазами.
Чтобы подтвердить свои предположения, исследователи провели аналогичный эксперимент на макаках. Одному животному они ввели плацебо в один из глаз, трем другим — аденовирусный препарат. Через три месяца аденовирусные векторы удалось обнаружить в нетронутых глазах у всех трех животных: следы характерной ДНК нашлись в сетчатке и зрительном нерве. На основании этого авторы работы заключили, что и у пациентов в ходе клинического исследования улучшения зрения может быть связано именно с миграцией препарата из одного глаза в другой.
Каким способом аденовирусные векторы перемещаются между глазами, до сих пор неизвестно. Сами исследователи отмечают, что в испытаниях других генотерапевтических препаратов от глазных болезней таких эффектов раньше не обнаруживали. Также они предполагают, что путей миграции аденовирусной ДНК может быть несколько: она могла попасть из глаза в глаз через кровоток в составе собственно вектора или уже модифицированных митохондрий, а могла пойти и более длинной дорогой — через головной мозг по отросткам нейронов.
Дизайн этого эксперимента не позволяет выяснить, как именно путешествуют между глазами генотерапевтические препараты. Однако судя по тому, что и для людей, и для макак лечение оказалось безопасным и не вызвало ни тяжелых побочных эффектов, ни возникновения опухолей, ни каких-либо еще негативных последствий для здоровья, можно заключить, что генная терапия остается безопасной для людей с глазными болезнями — даже если барьер между глазом и остальным организмом на поверку оказывается более хрупким, чем считалось раньше.
В 2021 году глазные болезни также попробовали лечить с помощью CRISPR/Cas — и это был первый случай, когда систему генетического редактирования ввели пациентам in vivo
. Кроме того, недавно у мышей впервые удалось восстановить остроту зрения после глаукомы — с помощью репрограммирования клеток.
Полина Лосева
Что может произойти в первые дни его жизни?
С появлением малыша на свет развитие его глаз не останавливается, а если кроха появился на свет раньше срока, вероятность развития глазных патологий после его рождения значительно повышается. Все недоношенные ребятишки входят в группу риска по развитию тяжелого заболевания – ретинопатии, которое проявляется необратимым изменением сетчатки и стекловидного тела.
Главная причина возникновения этой проблемы – избыток света и кислорода во внешней среде и незрелость зрительной системы ребенка. В норме до 34 недель внутриутробного развития продолжается процесс формирования кровеносных сосудов сетчатки. Если малыш покидает полость матки раньше этого срока, сосуды начинают развиваться неправильно, что и становится причиной серьезных осложнений. В легких случаях ретинопатия самопроизвольно поддается обратному развитию, но в тяжелых – становится причиной утраты зрения.
Виды наследственных заболеваний глаз?
Условно болезни органов зрения, обусловленные генетикой, можно разделить на три большие группы. В первую следует включить аномалии глаз, связанные с заболеваниями других органов. В данном случае речь идет о различных синдромах, при которых наблюдаются психические отклонения, внешние дефекты, в том числе аномалии. Во вторую группу входят нарушения, которые проявляются не сразу и не требуют срочного лечения. Сюда можно отнести гетерохромию, дальтонизм и дефекты рефракции. В третьей группе находятся наследственные заболевания глаз, которые диагностируют у новорожденных.
Причины развития
m http-equiv=»Content-Type» content=»text/html;″>g class=»lazy lazy-hidden» src=»https://pro-acne.ru/wp-content/plugins/a3-lazy-load/assets/images/lazy_placeholder.gif» data-lazy-type=»image» data-src=»https://medicina.win/images/wp-content/plugins/wp-special-textboxes/themes/stb-metro/info.png»>
Обратите внимание!
- дегенеративные или воспалительные процессы в утробе матери, развивающиеся на фоне инфекционных заболеваний и распространяющиеся на плод (поражение герпесом, краснуха, токсоплазмоз);
- влияние на плод так называемых тератогенных факторов.Это может быть употребление будущей матерью алкоголя, курение, прием определенных лекарственных препаратов, а также воздействие на организм беременной ионизирующего излучения.
- различные генетические патологические синдромы, которые проявляются в аномалиях развития человеческих органов (в том числе – глаз);
- образование амниотических перетяжек, которые передавливают плод и способствуют замедлению или остановке его развития или развития определенных органов (тяжи Симонара).
Среди причин развития приобретенного микрофтальма – различные виды облучений (от радиационного до рентгеновского), ретролентальная фиброплазия (тяжелое заболевание структур глаза), токсоплазмози перенесенные в детстве офтальмологические оперативные вмешательства.
Как избежать проблем?
С целью профилактики врожденных глазных патологий, доктора рекомендуют каждой паре родителей, которые страдают расстройством зрения или имеют родственников с офтальмологическими заболеваниями, обращаться за консультацией к медицинскому генетику. Кроме того, на этапе планирования беременности необходимо пройти полное обследование на наличие инфекций, передающихся половым путем, цитомегаловируса и токсоплазмоза.
Будущим мамам во время беременности следует избегать факторов, которые могут спровоцировать нарушение внутриутробного развития. Прием лекарственных препаратов разрешается только по назначению врача, контакт с инфекционными больными не допускается.
В первые дни жизни, особенно – если малыш появился на свет раньше срока, он должен быть осмотрен детским офтальмологом. Профилактические осмотры повторяются через три месяца и в конце первого года жизни, а при появлении подозрений на наличие глазной патологии посетить офтальмолога следует незамедлительно.
Первичная профилактика глаукомы
Для сведения к минимуму действия негативных факторов необходимо контролировать следующие условия:
Офтальмологические заболевания. Травмы области глаз и катаракта могут спровоцировать негативную реакцию на повышение ВГД из-за нарушений циркуляции внутриглазной жидкости. Для профилактики глаукомы рекомендуется своевременно лечить сопутствующие заболевания глаз.
- Рацион. На питание и гемодинамику глаз существенное негативное влияние может оказывать однообразная несбалансированная диета. Крайне нежелателен дефицит белковой пищи, витаминов и минералов. Для полноценного восполнения питательных веществ в рационе обязательно должны присутствовать нежирное мясо, рыба, растительная пища, молоко и кисломолочные продукты.
- Физическая активность. Умеренные нагрузки способствуют активизации всех процессов, в том числе – ускоряют кровоток и газообмен. Регулярное выполнение комплекса физических упражнений минимизирует риск развития гипоксии зрительной системы. В то же время стоит учитывать, что поднятие тяжестей и чрезмерные нагрузки могут спровоцировать нестабильность внутриглазного давления.
- Профилактика. При отягощённой наследственности, а также уже имеющихся офтальмологических заболеваниях необходимо регулярно проходить профосмотр у окулиста. Глаукома на начальных стадиях никак себя не проявляет, и изменения на глазном дне могут развиваться очень медленно. Только опытный специалист имеет возможность выявить болезнь на ранних стадиях, когда лечение наиболее эффективно и прогноз благоприятен.
Небольшие дефекты, которым не нужно специальное лечение
Ряд заболеваний не требует срочного лечения или не поддается исправлению. При этом они не всегда доставляют сильный дискомфорт пациенту. Так, один из самых необычных и достаточно редких недугов — гетерохромия. Данная патология характеризуется разным цветом радужных оболочек. Подобные аномалии глаз, вызванные наследственным фактором, не лечат. Исключение составляют ситуации, когда гетерохромия становится располагающим фактором к развитию какой-либо иной болезни. Но всегда есть возможность скорректировать дефект при помощи цветных контактных линз.
Еще одна наследственная патология глаз — дальтонизм, при котором больной не может различать один или несколько цветов. Патология принимает различные формы. Случаи, когда человек не видит никаких оттенков, кроме белого и черного, встречаются достаточно редко. Врожденный дальтонизм вылечить невозможно. Частично дефект удается компенсировать специальными очками или линзами. Нельзя отнести эту болезнь к очень тяжелым. В основном пациенты с таким диагнозом не испытывают сильного дискомфорта и могут жить полноценной жизнью.
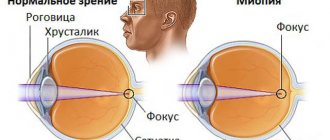
Есть и другие виды наследственных заболеваний глаз, при которых лечение назначается не сразу после рождения ребенка. Одна из самых распространенных патологий органов зрения — близорукость. Причины ее развития изучаются уже много лет. В 2021 году группой зарубежных ученых был обнаружен ген миопии. Он находится в 15-ой хромосоме и называется RASGRF1. Но здесь также не все просто, как и с остальными болезнями, имеющими генетическую природу. Дело в том, что данный ген есть у всех, но к близорукости приводят лишь некоторые его вариации.
Ученые обнаружили и другие закономерности. Наследуется не только сам дефект рефракции, но и его степень. Есть два типа наследования: аутосомно-доминантный и аутосомно-рецессивный. В первом случае болезнь переходит непосредственно от родителя к ребенку. Если запускается именно этот алгоритм, то вероятность рождения у близоруких взрослых малыша с миопией составляет почти 100%. В то же время у здоровых родителей никогда не родится ребенок с наследственной миопией. Немного другая ситуация наблюдается при наследовании по аутосомно-рецессивному признаку. Человек может быть носителем аномального гена, не болея при этом сам. Детям своим он его передаст, но не факт, что миопия у них когда-нибудь возникнет. Иными словами, близорукие встречаются не в каждом поколении. Есть и еще интересные нюансы: по первому признаку наследуется легкая и средняя степень, а по второму — сильная.
Лечится наследственная близорукость комплексно: процедурами, каплями, гимнастикой для глаз. Но избавиться навсегда от патологии можно только оперативно. Операции не назначаются до 18 лет. Поэтому миопия и относится к дефектам, которые нельзя вылечить сразу. При этом запускать ее и оставлять полностью без лечения и коррекции опасно.
Врожденная глаукома
Как показывает статистика, эта патология встречается примерно в 1 случае на 10 тыс. новорожденных. Заболевание может быть обусловлено наследственностью или развиться во внутриутробном периоде. Опасность врожденной глаукомы в том, что в случае несвоевременного выявления, а также при отсутствии консервативного или хирургического лечения заболевание может привести к слепоте ребенка (как правило, слепота наступает еще в дошкольном возрасте).
К врожденной глаукоме могут привести инфекционные болезни, перенесенные матерью в период беременности, гипертермия, авитаминоз, рентгеновское излучение в процессе лучевой диагностики, а также некоторые другие факторы, которые приводят к нарушению оттока внутриглазной жидкости.
В случаях выявления у ребенка признаков патологии проводится консультация офтальмолога и дополнительные исследования, после чего маленького пациента направляют в стационар для проведения консервативного лечения или операции. Чем раньше выявлена проблема и проведено правильное лечение глаукомы, тем больше шансов на сохранение зрительных функций.
Лечение
Статья носит информационный характер. Не стоит обращаться на форумы с целью получения рекомендаций по лечению. Только окулист может поставить диагноз, выбрать способ устранения аномалии.
Консервативная терапия не увеличивает глазное яблоко, не вылечивает микрофтальм, но уменьшает возможность возникновения осложнений. Для этого пользуются каплями и мазью Мирамистин, антисептиком Хлогексидин, носят телескопические очки.
Визуально распознать болезнь не составит труда с первого дня жизни младенца
Мидриатик, применяемый для диагностики и лечения, – глазные капли Мидриацил.
Хирургическое лечение зависит от степени уменьшения глазного яблока и от того, как долго длится патология. К вмешательству приступают, когда развивается глаукома, отслаивается сетчатка.
Если изменение не превышает 3 мм, выполняют задний бандаж склеры. Во время операции к этой оболочке крепят трансплантат из ткани.
Протез, который способствует сохранению подвижности глазного яблока, необходим при значительной гипоплазии.
Если развитие микрофтальма привело не только к снижению зрения, но и к слепоте, прибегают к пластической операции, чтобы избавить пациента от видимого дефекта. После ее выполнения пораженный глаз закрывают одностенным протезом.
Курение во время беременности часто приводит к развитию мутаций у плода
Имплантационная методика показана, если переднезадняя ось изменилась не больше, чем на 10 мм.
Чтобы предотвратить возникновение врожденного вида микрофтальма, женщине, вынашивающей ребенка, нужно отказаться от употребления спиртного, приема психоактивных веществ, перестать курить, а рационально питаться, регулярно обследоваться у врачей.
Когда существует риск, что патология может передаться по наследству, нужно не игнорировать проведение скрининга.
Не допустить значительного ухудшения зрения, появления асимметричности лица помогает ранняя диагностика аномалии, своевременное лечение инфекционных болезней.
Неосторожность, которая может стать причиной полной потери зрения, – ожог глаз от сварки.
Часто микрофтальм сопровождают заячья губа и волчья пасть
Правила проведения массажа при дакриоцистите новорожденных найдете по ссылке.
Причины возникновения аномалий
В целом, патологии имеют различную этиологию и природу, однако чаще бывают врожденными. Отклонения в формировании, деформации или повреждения хрусталика возникают в связи с внутриутробными отклонениями, воспалительными процессами и генетическими заболеваниями, наследственными пороками развития соединительных тканей. Чаще причины аномалий кроются в изменении химического состава вещества хрусталика еще в эмбриональный период, но также могут возникать вследствие возрастных трансформаций или механических повреждений органов зрения.
Экстракональная патология
Периорбитальные абсцессы
На нативном (безконтрастном) КТ-изображении пациент с явным периостальным или периорбитальным абсцессом. Не стоит медлить и ждать периферического усиления при контрастировании чтобы делать вывод об абсцессе! В каждом другом месте вы проводите контрастирование и ждете красивую картинку с переферическим усилением по типу обода, чтобы называть образование абсцессом, если не сказать большего, флегмоной. Лечение — лечение синусита.
У детей любое распространение за пределы пазух следует называть абсцессом.
У детей периорбитальное пространство более ячеисто, и патологический процесс легко распространяется. Так что будьте уверены и настойчивы, называя небольшие изменения абсцессом.
Периорбитальные абсцесс может привести к венозному тромбозу в верхней и нижней глазной вен.
При грибковых синуситах (aspergillosis), вы можете даже получить тромбоз кавернозного синуса и кавернозно-каротидную фистулу.
Орбитальный и периорбитальный целлюлит
На изображении пациент, который доставлен по экстренным показанием с симптомом «красного глаза» и экзофтальмом. Знание различия между орбитальным и периорбитальным целлюлитом является важным и базируется на анатомической структуре, которая называется орбитальной перегородкой (глазничная перегородка, или septum orbitale).
Если пациент приходит с симптомом «красного глаза», а воспаление включает в себя орбитальную перегородку и распространяется к наружи от нее, выставляется диагноз периорбитальной целлюлит и лечение пациента с оральными антибиотиками осуществляется в амбулаторных условиях.
В случае на изображении выше, вовлечены структуры и позади перегородки. Этот пациент имеет орбитальный целлюлит и нуждается в стационарном лечении антибиотиками внутривенно.
Патология крыла Клиновидной кости
На КТ изображение пациент с экзофтальмом из-за поражения крыла клиновидной кости. Есть четыре патологии крыла клиновидной кости, которые могут вызвать экзофтальм:
- дисплазия
- фиброзная дисплазия
- Болезнь Педжета
- менингиома с гиперостозом крыла клиновидной кости
На изображениях — менингиома крыла клиновидной кости
Поражения слезной железы
Заболевания слезной железы могут быть разделены на следующие типы:
- Гранулематозныйлимфойдный Саркоидоз, псевдоопухоль, лимфома, синдром шегрена, болезнь микулича, туберкулез
- Железистыйэпителиальный Плеоморфная аденома, железисто-кистозная карцинома
Воспалительные состояния являются на сегодняшний день наиболее распространенными поражениями слезной железы (синдром Шегрена, туберкулез, гриб, псевдоопухоль). Эти состояние не вызывают опухолевое поражение.
- воспаление 64% псевдоопухоль, дикриоаденит
Наиболее распространенным состоянием с наличием опухоли — это лимфомы, затем плеоморфные аденомы. Эпителиальные опухоли, включая железисто-кистозные опухоли являются редкостью.
Сосудистые мальформации
Сосудистые аномалии могут распологаться как интраконально, так и экстраконально, или же во всех пространствах, и это причина, почему они не обсуждаются в категориях выше.
Прежде, чем мы покажем вам некоторые случаи, мы должны обсудить систему классификации сосудистых аномалий по Mulliken и Glowacki в области шеи и головы, которая широко распространена в настоящее время.
классификации орбитальных сосудистых аномалий по Mulliken и Glowacki
- Капиллярные гемангиомы
- Артериовенозные мальформации
- Венозно-лимфатические пороки развития
- Расширение орбитальных вен
- АВФ, дуральная АВМ
Капиллярная гемангиома
Первой аномалией в системе Mulliken и Glowacki стоит капиллярная гемангиома. Капиллярные гемангиомы имеют следующие характеристики:
- новообразование с фазой роста 6-12 мес возраста и инволюционной фазой при 5-7-летнего возраста.
- В основном располагаются в коже, но можно и увидеть в экстракональном пространстве орбиты.
- Обычно регрессирует спонтанно, но иногда проводят лечение стероидами, лазером или интерферонами.
- Может быть частью PHACE -синдрома: пороки развития задней черепной ямки, гемангиомы, артериальные аномалии, сердечные пороки и глазные нарушения, такие как колобома, глаукома.
Венозные мальформации
Второй аномалией в системе Mulliken и Glowacki является Артериовенозные мальформации На изображение представлена венозная мальформация. Определеяется интракональное поражение в купе с флеболитом. Большинство из них однокамерные, но в данном случае многокамерное.
Венозные мальформации имеют следующие характеристики:
- Наиболее распространенное интраканальное образование у взрослых
- Чаще наблюдается у женщин, средний возраст 45 лет, с медленным прогрессирующим увеличением
- Также известны как кавернозные мальформации, но этот термин уже не используется
- Это поражение характеризуется флеболитом и может быть частью синдрома Маффучи и синдрома Бина
- Вы можете наблюдать их в динамике, как правило, они будут расти с течением времени и, возможно, потребуется операция
Лимфатические пороки
Следующие в списке лимфатические или вено-лимфатические пороки. Это небольшие кистозные зоны, которые часто кровоточат после незначительной травмы. Они могут иметь высокую интенсивность сигнала на T1WI из-за высокого содержания белка или кровоизлияния. Они обычно не контрастируются, если нет венозного компонента, который может законтрастироваться. Это поражение относиться к «семейству» кистозной гигромы.
Другие характеристики:
- Отрочество (60% до 16 лет)
- Может внезапно кровоточить в результате появляются уровни жидкости
- Может быть эктсракональной или мультикомпартментальной
- Связана с внутричерепными пороками, как при синдроме Тернера или фетальный алкогольный синдром
- Отсутствие контрастного усиления при чисто лимфатических поражениях